2026年1月2日(纽约时间1月1日),瓯江实验室宋伟宏院士团队王朝课题组联合广州医科大学附属妇女儿童医疗中心李俊教授课题组和周文浩教授课题组,在国际科学期刊《科学进展》(Science Advances)在线发表突破性研究成果“Multidimensional mapping of stimulation-responsive regulatory elements and candidate causal variants in T cell activation”,瓯江实验室为第一完成单位。

在人类基因组中,超过90%的疾病相关遗传变异藏身于非编码区域。这些区域如同“暗物质”,长期阻碍着功能基因组学研究与精准医学发展。尽管全基因组关联研究(GWAS)已发现许多与免疫相关疾病关联的非编码变异,但如何解析其作用机制及特定背景依赖性仍然是该领域的重大挑战。因此,团队开发了一种融合多层证据的综合方法,以CD4+ T细胞的激活作为模型系统,深入表征并整合了多层调控基因组学、功能基因组学和围绕T细胞刺激的遗传证据,描绘了T细胞激活过程中的动态调控图谱,成功鉴定出一系列刺激响应性基因、调控元件和候选因果变异。
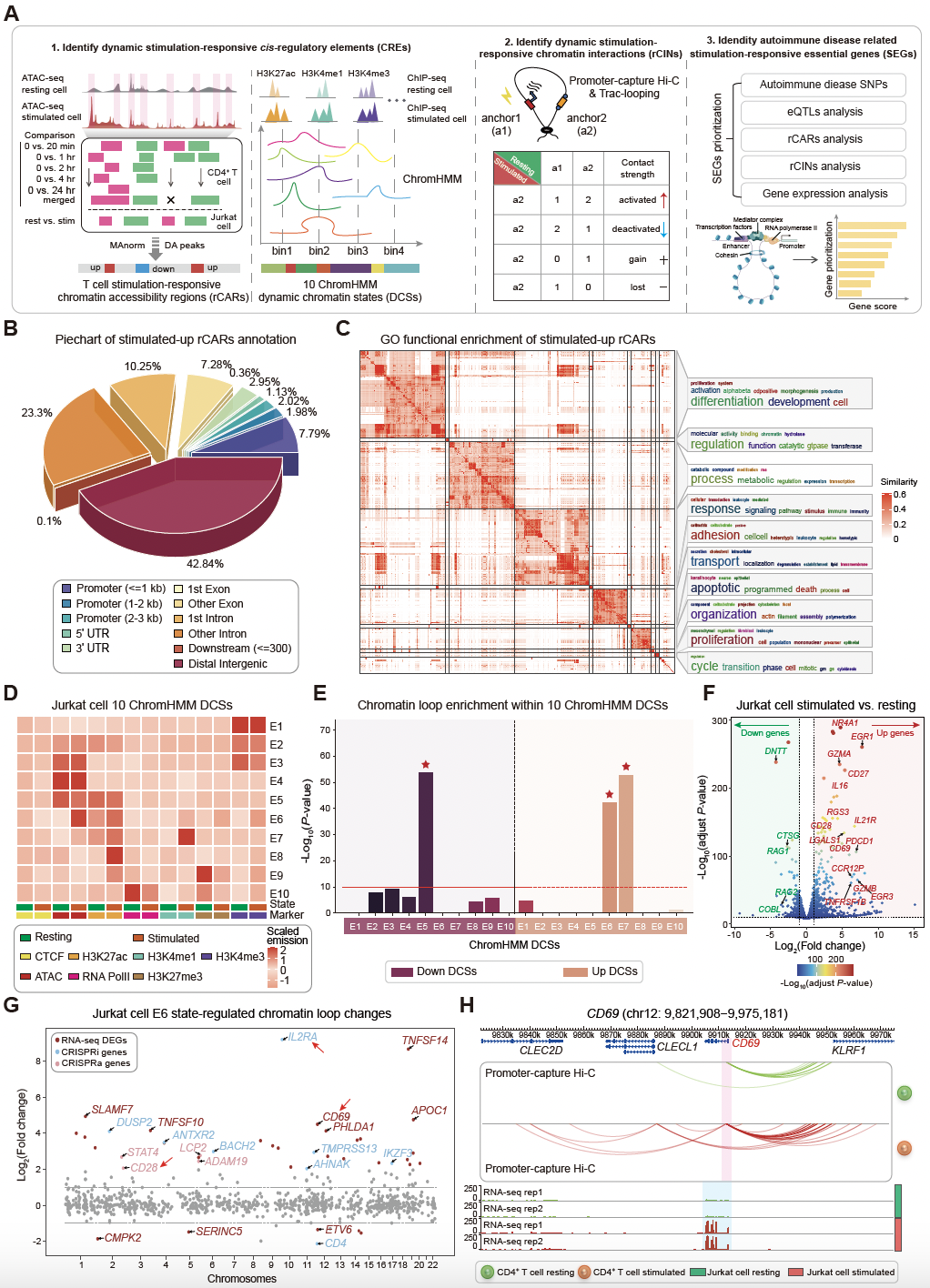
融合多层证据建模揭示T细胞激活过程中的动态染色质状态变化
为系统解析T细胞活化过程中的转录调控网络,研究团队整合了ATAC-seq、组蛋白修饰ChIP-seq及转录组测序等多组学数据,对刺激响应性基因进行全基因组功能优先级排序。结果表明,CD28作为排名最靠前的关键基因,在T细胞活化中发挥核心调控作用。研究采用高分辨率染色质构象捕获技术(Capture Hi-C)绘制了CD28基因座的三维染色质互作图谱,并利用高通量CRISPR激活(CRISPRa)技术鉴定出多个条件特异性的顺式调控元件。这些调控元件在时空维度上精确控制CD28基因在不同活化阶段的转录动态,形成精密的分层调控网络。通过整合自身免疫性疾病GWAS数据和T细胞特异性eQTL数据,研究团队采用精细定位、共定位分析和功能验证策略,最终锁定了位于CD28基因下游调控区域的关键插入变异rs5837875(A>AT)。
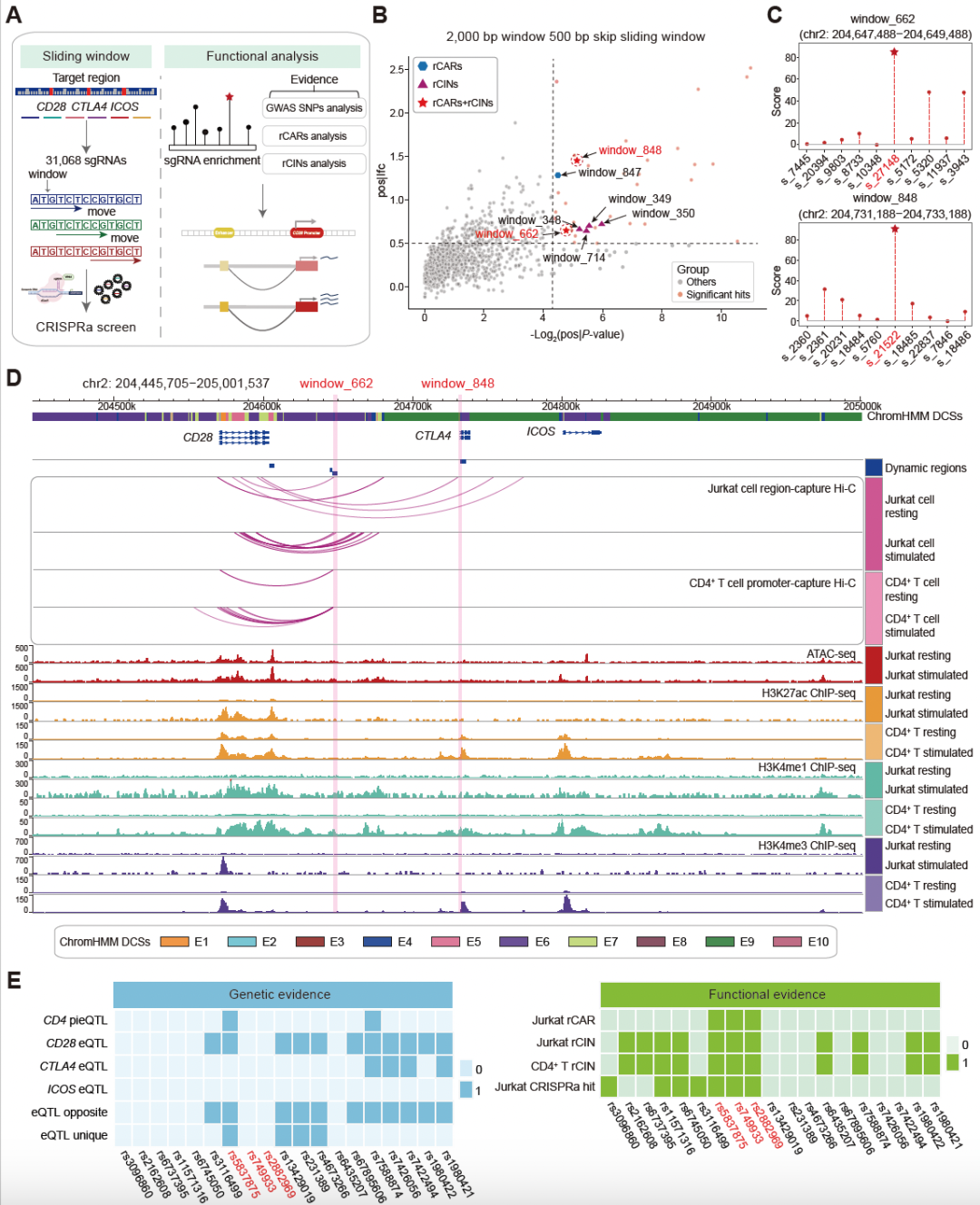
CD28基因座CRISPR激活筛选鉴定刺激响应性调控元件及因果候选变异
接下来,团队深入揭示了非编码区插入变异rs5837875(A>AT)如何通过刺激响应性机制调控CD28基因表达,进而促进T细胞过度激活的精细分子机制。该综合性和背景依赖策略为破译复杂疾病遗传风险的调控机制建立了一条较为全面而系统的研究途径。
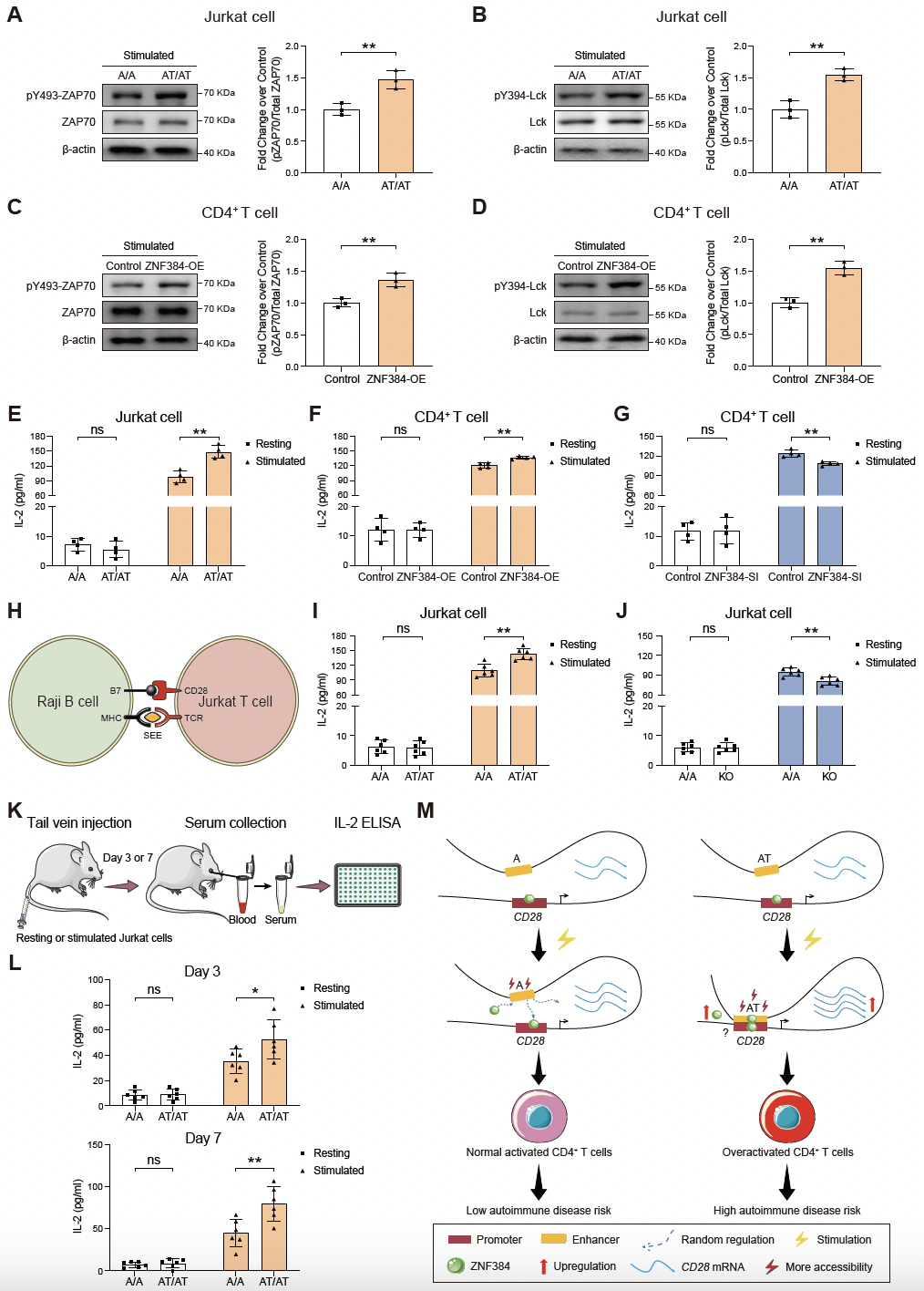
rs5837875以刺激响应性方式调控CD28表达促进T细胞过度激活的分子机制
该研究的创新性在于建立了一套系统性的多维整合框架,能够在复杂的细胞环境背景下精准识别功能性调控元件和因果变异。这一策略不仅适用于T细胞激活研究,更可推广至其他免疫细胞类型和疾病(如阿尔茨海默病)模型,为破译复杂疾病的“暗物质”调控机制提供了新的方法学范式。团队正在将该研究策略应用于阿尔茨海默病研究,有望为阿尔茨海默病等复杂疾病的早期风险评估、分子分型和个体化治疗策略的制定提供理论基础。未来,基于该策略开发的靶向干预手段可能为临床治疗带来新突破。
瓯江实验室王朝研究员、广州医科大学附属妇女儿童医疗中心董玮博士和冯香玲博士生为文章的共同第一作者。瓯江实验室宋伟宏院士、王朝研究员和广州医科大学附属妇女儿童医疗中心周文浩教授、李俊教授为文章的共同通讯作者。瓯江实验室是本文第一作者单位和共同通讯作者单位。工作得到了国家自然科学基金项目、国家重点研发计划、浙江省自然科学基金、中央引导地方科技发展基金等项目的资助。
原文链接:
https://www.science.org/doi/10.1126/sciadv.ady2539