转录因子(TFs)的正常核质分布对维持细胞稳态至关重要,其异常定位与多种癌症发生发展密切相关。因此,逆转肿瘤相关转录因子的错误定位是极具潜力的抗癌治疗策略,开发一种能够特异性重定位TFs的通用平台具有重要科学意义与临床价值。
近日,瓯江实验室吴文灿研究员团队联合湖南大学叶茂团队在Science Advances 在线发表题为“Engineered anchoring aptamers induce relocalization and functional inactivation of transcription factors”的研究论文。该研究通过模拟细胞内锚定蛋白调控靶标蛋白定位的作用机制,开发了锚定核酸适体作为转录因子重定位的通用平台。锚定核酸适体是一种异源双功能核酸分子,由连接子连接两个配体构成:一个配体靶向质膜锚定蛋白,另一个配体则募集特定的转录因子。作为概念验证,作者利用靶向Ras蛋白的Ra1核酸适体,以及特异性识别p65或E2F1的DNA配体,构建了相应的锚定核酸适体。锚定核酸适体同时结合Ras蛋白与p65或E2F1,能有效诱导p65或E2F1向细胞质重新定位并使其功能失活。通过使用锚定核酸适体的慢病毒表达系统,作者实现了p65在细胞质中的持续滞留,并显著抑制了肿瘤生长。本研究建立了一个通用的转录因子重定位平台,为开发创新的抗癌治疗策略提供了重要思路。

文章创新点
创新性策略:首次提出并验证了锚定核酸适体这一双功能分子平台,实现无需化学修饰或基因编辑的内源性TFs重定位。
新型干预分子:传统小分子抑制剂在靶向转录因子时面临缺乏可成药结合位点的挑战。而锚定核酸适体利用易于合成的核酸作为转录因子配体,提供了一类针对转录因子的简便、通用的新型干预分子。
治疗潜力:利用慢病毒表达系统介导锚定核酸适体的持续表达,在非小细胞肺癌模型中实现了持久的p65重定位及肿瘤抑制,展示了这一平台在治疗转录因子相关疾病中的广阔应用前景。
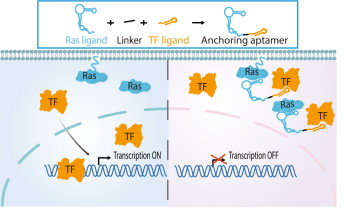
图1. 锚定核酸适体的设计思路及作用机制。其由 Ras 配体、转录因子(TF)配体和连接子组成,通过同时结合 Ras 与 TF ,诱导TF胞质重定位及功能失活。
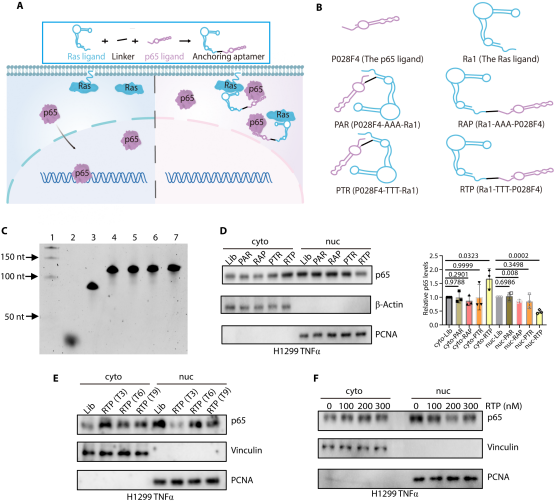
图2. 锚定核酸适体的构建。成功构建靶向 p65 的锚定核酸(如 RTP),经凝胶电泳验证合成效果,通过细胞实验确定三脱氧胸腺嘧啶连接子最优,200nM 浓度可有效促进 p65 胞质积累。
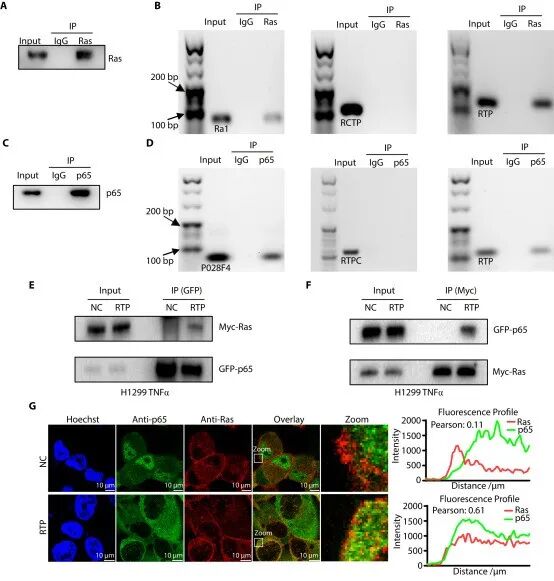
图3. RTP作用机制。RTP 可同时结合Ras、p65,并介导 Ras-RTP-p65 三元复合物形成。
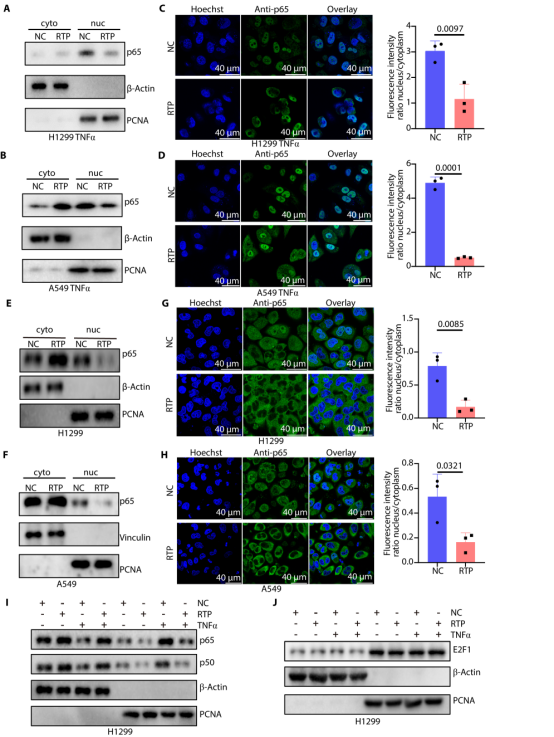
图4. RTP重定位p65。RTP 在诱导和非诱导条件下,均能使诱导NSCLC 细胞中 p65的胞质重定位,且这一作用具有特异性。
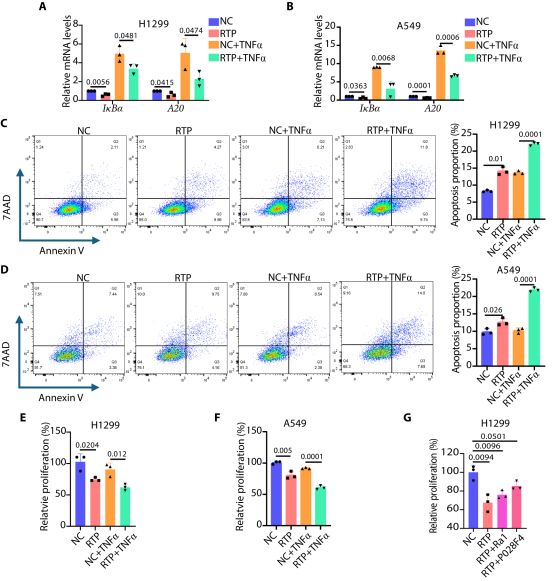
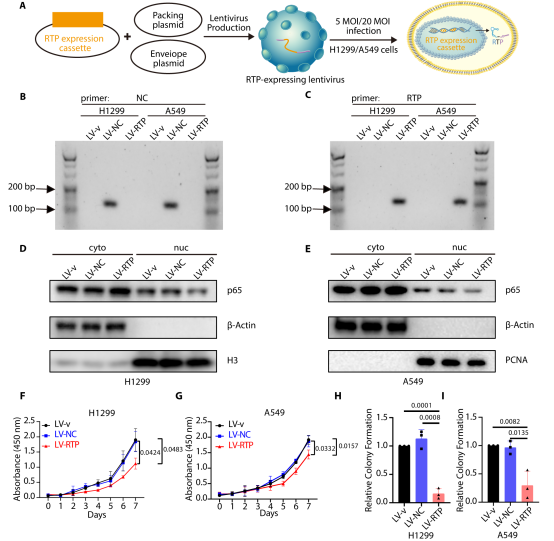
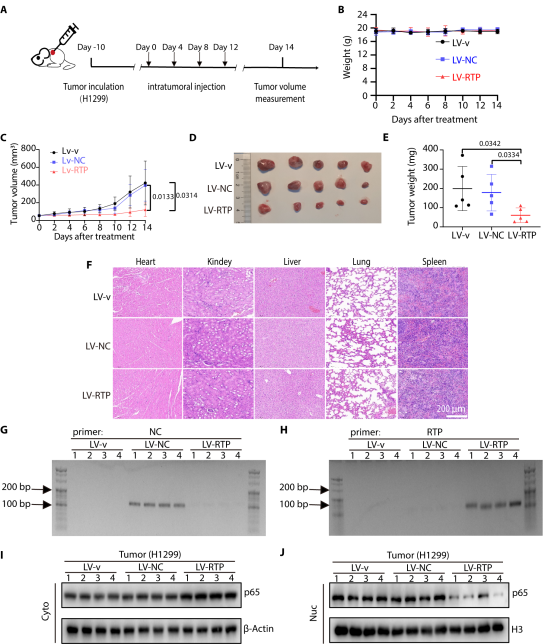
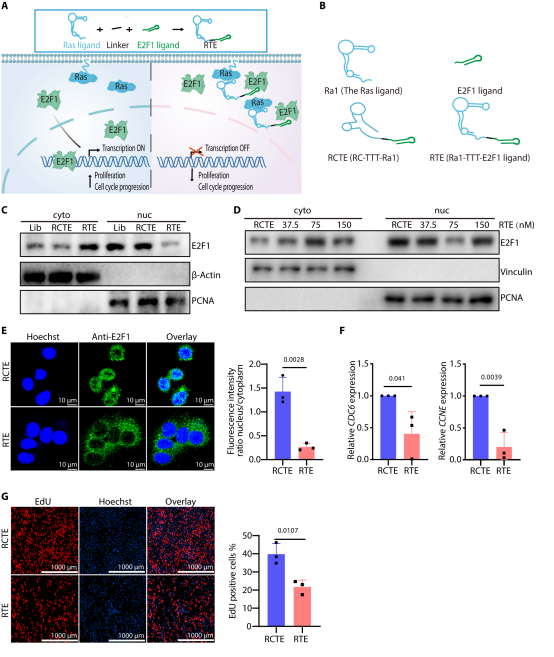
图8. 锚定核酸适体的通用性。设计靶向 E2F1 的锚定核酸适体 RTE,75nM 浓度即可诱导 E2F1 胞质重定位,下调其靶基因表达,阻滞细胞周期并抑制 HeLa 细胞增殖,验证该策略的普适性。
总结与展望
作者成功开发出锚定核酸适体这一新型转录因子(TF)重定位平台,为转录因子治疗性干预及癌症治疗提供了全新策略。该策略突破了基于小分子的重定位策略难以靶向 TF 的瓶颈,兼具设计灵活、特异性强等优势,具有广泛适用性。未来可进一步优化锚定核酸适体的设计与递送系统,提升其稳定性和组织特异性;拓展至更多肿瘤相关 TF,开发个性化抗癌疗法;同时探索其在炎症等其他 TF 功能异常疾病中的应用,还可通过替换定位配体,实现 TF 向不同亚细胞结构的精准转运,为疾病治疗提供更多创新思路。
瓯江实验室吴文灿研究员和吴建章教授、湖南大学叶茂教授为本文通讯作者;瓯江实验室吴文灿团队博士后凌能为本文第一作者。瓯江实验室为本文第一作者单位和第一通讯作者单位。
原文链接:
https://pubmed.ncbi.nlm.nih.gov/41477872/