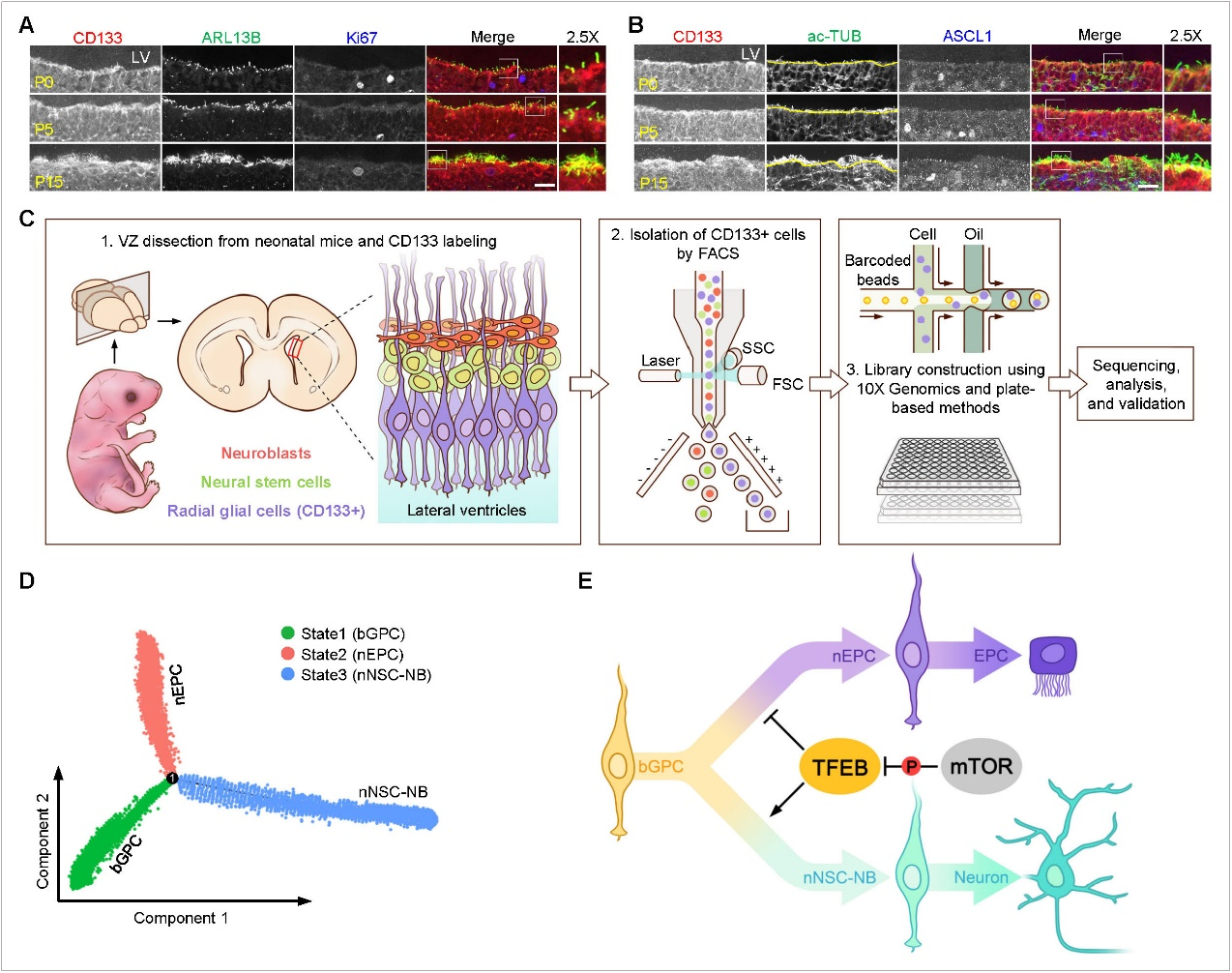
近日,瓯江实验室主任宋伟宏院士团队副研究员郑建群联合南方科技大学陈曦教授团队在国际生物学领域经典期刊《Plos Biology》上发表了题为“Lineage trajectories and fate determinants of postnatal neural stem cells and ependymal cells in the developing ventricular zone”的研究论文,首次绘制出脑室区胶质前体细胞朝神经干细胞以及室管膜细胞分化的完整轨迹,并鉴定出转录因子TFEB精细调控胶质前体细胞的分化方向。 成年哺乳动物的神经干细胞(neural stem cells, NSCs)主要存在于脑室区(ventricular zone, VZ)以及海马齿状回区(dentate gyrus,DG)。VZ由围绕脑室的1-2层细胞组成,其分布范围及所含NSC数量均超过DG。NSCs具有分化为多种类型神经元的潜能, 因此在神经损伤修复及神经退行性疾病治疗中具有重要应用价值。空间上,NSCs被长有多纤毛的室管膜细胞(ependymal cells, EPCs)包围,EPCs的多纤毛通过节律性摆动促进脑脊液流动,进而调节NSCs的自我更新和分化。NSCs和EPCs都是由具有高度内在异质性的胶质前体细胞(glial progenitor cells, GPCs)在个体出生后分化而来。因此揭示GPCs分化为NSCs和EPCs的具体轨迹,明确分化过程中参与调控的关键分子,将为NSC疗法的具体应用提供重要理论依据。 研究团队利用CD133标记结合流式分选技术分离脑室区细胞,通过10x与SMART-Seq3两种方法构建单细胞转录组文库,经数据分析后两种建库方法都得到了从GPCs分化为NSCs以及EPCs的连续分支轨迹。沿NSC分支的分析鉴定出一种新的中间态细胞,该细胞同时表达primitive oligodendrocyte progenitor (OPC)和neuroblast(NB)的标记基因,免疫荧光实验验证了此类细胞的存在。研究人员发现转录因子NPAS1和FOXA2对EPC方向的分化至关重要。值得注意的是,转录因子TFEB 可调控GPCs的命运决定,该功能独立于其作为溶酶体发生主要调控因子的经典功能。具体而言,TFEB 的激活通过两方面发挥作用:一方面与 LHX2 协同抑制多纤毛基因的表达,从而抑制 EPCs 的过度生成;另一方面促进 GPCs 分化为 NSCs,进而分化为神经元。在此过程中,mTOR 对 TFEB 的 S210 位点的磷酸化调控发挥关键作用。 该研究揭示了VZ发育过程中各类前体细胞的动态谱系变化,并为靶向 TFEB的临床药物在VZ相关疾病(如脑积水和神经退行性疾病)中的潜在应用提供了新见解。 瓯江实验室宋伟宏院士团队的副研究员郑建群和博士后陈雅文为本文的共同第一作者,宋伟宏院士、郑建群副研究员和南方科技大学的陈曦教授为文章的共同通讯作者。博士研究生胡俣琨、张云龙以及硕士研究生朱宇健、许曼琳、林洁对此项研究做出了重要贡献。瓯江实验室为本文第一作者单位和共同通讯作者单位。 原文链接: https://journals.plos.org/plosbiology/article?id=10.1371/journal.pbio.3003318